Certifications Nos sérums

Notre sérum, traçable à la source
Lorsque les scientifiques choisissent leurs sérums, la source géographique et la traçabilité des produits sont d’une importance capitale.
Traçable à la source
Lorsque les scientifiques sélectionnent leurs sérums, l’origine géographique et la traçabilité sont d’une importante capitale.
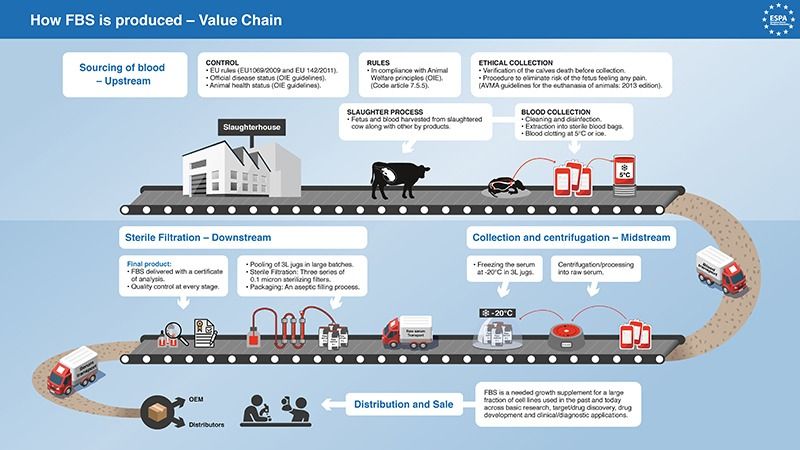
Notre sérum fœtal bovin est extrait du sang total coagulé prélevé aseptiquement du fœtus par ponction cardiaque.
Biowest contrôle rigoureusement chaque lot fabriqué :
- De la collection de sérum,
- Pendant son traitement et sa production,
- À l’emballage final dans nos locaux.
Biowest analyse, classe et teste ses produits avant de les expédier à des clients du monde entier.
Notre système de qualité peut retracer les matières premières jusqu’au fournisseur d’origine et aux abattoirs où elles ont été recueillies.
Le système d’intégration verticale de Biowest assure la certification d’origine et la traçabilité complète des sérums.

FBS Sources Worldwide
Biowest fournit un large éventail d’origines de sérums, y compris des sources d’Amérique du Sud ainsi que de l’Union européenne (UE) et de sources approuvées par le Département américain de l’agriculture (USDA).
Le choix de l’origine FBS est déterminé par les besoins des clients, les exigences d’importation et l’approvisionnement mondial.
Les professionnels trouveront que Biowest est le partenaire idéal pour répondre à leurs besoins, comme le choix de l’origine du sérum qui fournit des performances et des résultats optimaux.
Le SVF (Sérum de Veau Fœtal) est considéré comme un sous-produit animal qui n’est pas destiné à la consommation humaine.
La sécurité biologique est contrôlée par les règles européennes sur les sous-produits animaux :
- Règlement UE 1069/2009 et Règlement UE 142/2011
- État officiel de la maladie : ESB, fièvre aphteuse, etc.
- La santé animale de chaque pays est contrôlée par l’Organisation mondiale de la santé animale (OMSA)
Filtration et emballage
Le sérum brut groupé fœtal bovin est filtré par trois séries de filtres stérilisants de 0,1 micron. Le sérum filtré stérile est mis en commun pour assurer l’homogénéité.
Les produits Biowest sont conditionnés par un procédé de remplissage aseptique.
Nous nous assurons que les normes de stérilité industrielle à un niveau de 10-4 sont respectées à chaque étape de la fabrication.
Nos produits présentent un niveau de contamination bactérienne et fongique de moins de 1 unité sur 10000 tout au long de la fabrication.
Le niveau le plus élevé d’assurance de stérilité (10-6) ne peut être atteint sans stérilisation terminale.
La filtration et la distribution sont effectuées sous pression positive dans des salles à environnement contrôlé par filtre HEPA.
Chaque lot est livré avec un certificat d’analyse.
Certification de qualité Biowest
La procédure de test de stérilité est basée sur la pharmacopée européenne ou américaine, en fonction de l’emplacement de la filtration finale.
Pour atteindre le niveau d’assurance de stérilité le plus élevé, un nombre représentatif d’échantillons de chaque lot de production est sélectionné pour un test de stérilité avant la distribution.
Les sérums Biowest sont tous testés pour vérifier l’absence de bactéries aérobies et anaérobies, de champignons et de levures.
Chaque lot de sérums du produit final est testé pour détecter la présence de Mycoplasma.
Les sérums sont testés pour l’absence de Mycoplasma à l’aide d’un test de culture cellulaire dans le milieu de culture d’Axcell Biotechnologies. Notre test est précis dans les limites de la méthode de détection utilisée.
Selon l’espèce du sérum, chaque lot de sérum est testé pour les virus adventices en utilisant des techniques de culture cellulaire.
Les sérums sont testés pour vérifier l’absence des virus indiqués par inoculation avec des cellules GBK. La détection des virus se fait par immunofluorescence indirecte. Recherche d’anticorps : la présence d’anticorps spécifiques est détectée à l’aide d’un test ELISA. Par exemple, le sérum d’équidés est testé pour la présence d’anticorps contre l’anémie infectieuse équine.
Tous les pH-mètres de Biowest sont calibrés tous les jours avec des solutions standards.
L’osmolalité est déterminée par une température de congélation abaissée, selon la Pharmacopée Européenne EU Ph. 2.2.35.
L’osmomètre est étalonné à l’aide de normes traçables.
Tous les sérums Biowest sont testés pour déterminer et quantifier les niveaux d’endotoxine en utilisant un test chromocinétique – quantitatif – méthode D de la Pharmacopée Européenne EU Ph. 2.6.14.
La concentration d’hémoglobine résiduelle dans chaque lot est déterminée par un test quantitatif et colorimétrique afin de vérifier que les procédures de collecte et de traitement appropriées ont été suivies.
Détection des protéines | Méthodologie |
| Protein | Biuret Colorimetry |
| Albumin | Immunoturbidimetry |
| Globulin | Immunoturbidimetry |
Test | Method |
ALAT (SGPT) | Cinétique UV à 37°C |
Alkaline Phosphatase | Cinétique colorimétrique à 37°C |
ASAT (SGOT) | Cinétique UV à 37°C |
Bilirubin | Colorimétrie DPD / Caféine |
Calcium | Colorimétrie Arsénazo |
Gamma GT | Cinétique colorimétrique à 37°C |
Cholestérol | Cholestérase Trinder Colorimétrie |
Créatinine | Cinétique colorimétrique (Jaffé) |
Chlorure | Potentiométrie indirecte |
Glucose | Hexokinase UV |
Fer | Colorimétrie TPTZ |
Lactate Dehydrogenase (LDH) | Cinétique UV à 37°C |
Phosphore | Phosphomolybdate Colorimétrie |
Potassium | Potentiométrie indirecte |
Sodium | Potentiométrie indirecte |
Tryglicérides | Glycérokinase Colorimétrie Trinder |
Urée | Uréase UV |
Acide urique | Uricase Trinder Colorimétrie |
Chaque lot de sérum est testé pour les IgG à l’aide d’une méthode ELISA.
Chaque lot de sérum est fabriqué pour soutenir la croissance in vitro de lignées cellulaires particulières.
En plus de respecter nos spécifications strictes de contrôle qualité, chaque lot de sérums répond à trois critères de performance importants :
- Promotion de la croissance
- Efficacité du placage
- Efficacité du clonage
La performance biologique est évaluée à l’aide d’un milieu de culture cellulaire complété par une concentration finale de 10 % de sérum. Pendant la période d’essai, les cultures sont examinées au microscope pour déceler des anomalies morphologiques qui pourraient indiquer des composants toxiques dans le sérum.
Les lignées cellulaires suivantes sont utilisées pour mesurer le potentiel de croissance et la fonctionnalité :
| Lignée cellulaire | Type | Espèces |
| HELA | Cancer | Humain |
| L929 | Fibroblaste, macrophage | Souris |
| SP2/0-AG14 | Lymphome | Souris |
| MRC-5 | Poumon | Humain |
L’encéphalopathie spongiforme bovine (ESB) est testée pour le matériel d’origine bovine. Selon le règlement européen CE n° 999/2001, les animaux sont testés pour l’ESB avant que le sang correspondant ne puisse être traité. L’UE est pionnière dans le domaine des tests de dépistage de l’ESB et de l’identification individuelle des animaux par marquage auriculaire. Cela garantit la meilleure traçabilité possible et le plus faible risque d’ESB. Par conséquent, l’origine européenne est le premier choix des chercheurs au Japon et sur d’autres marchés sélectifs.
Le Japon et d’autres marchés sélectionnés font de l’UE leur premier choix.
| Test | Methode |
| Prionics | Western Blot |
| Bio-Rad | ELISA |
Remarque :
Même si l’Organisation mondiale de la santé animale confirme que le sang et les produits sanguins comme les FBS ne posent pas de risque de transmission de l’ESB, certains pays ont encore des exigences en matière d’ESB pour les FBS.
– Voir WOAH – Code sanitaire pour les animaux terrestres (2022)
Tous les produits Biowest portent des étiquettes indiquant les conditions d’entreposage appropriées, le numéro de lot et la date d’expiration.
Biowest garantit une performance optimale du sérum lorsque le produit est correctement stocké :
- Les sérums et le plasma animaux doivent être entreposés à -20 °C.
- Respecter la date d’expiration.
- La durée de conservation du sérum animal est de 60 mois, et celle du plasma animal, de 48 mois.
Utilisation prévue

Ces produits sont destinés uniquement à des applications de recherche ou à la fabrication ultérieure.
Il est de la responsabilité de l’utilisateur final de qualifier ces produits pour leur application spécifique.
Ces produits ne sont pas destinés à être utilisés en thérapie, pour des applications humaines ou vétérinaires, ni comme ingrédient pharmaceutique actif, ni pour l’alimentation humaine ou animale.
Leur sécurité et leur efficacité n’ont pas été établies pour le diagnostic ou d’autres utilisations cliniques.