ZertifizierungenUnser Serum

Unser Serum, rückverfolgbar bis zum Ursprung
Rückverfolgbarkeit bis zum Ursprung
Wenn Wissenschaftler ihre Seren auswählen, sind die geografische Quelle und die Rückverfolgbarkeit der Produkte von größter Bedeutung.
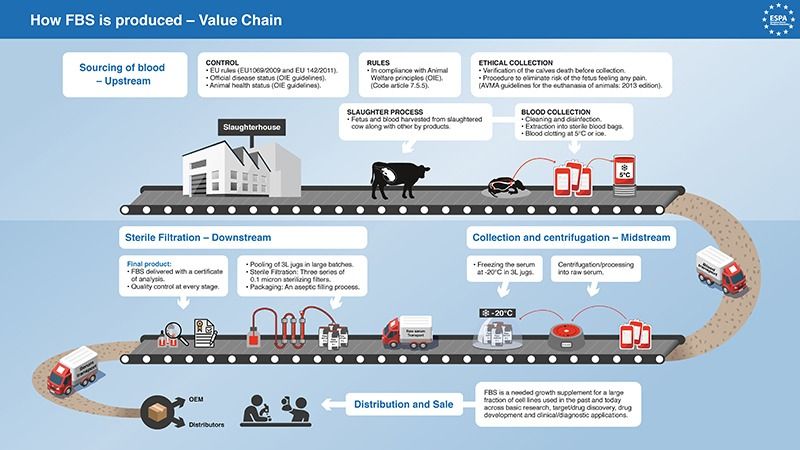
Unser fötales Rinderserum wird aus geronnenem Vollblut gewonnen, das dem Fötus aseptisch durch Herzpunktion entnommen wird.
Biowest kontrolliert jede hergestellte Charge rigoros:
- Von der Serumgewinnung an,
- während der Behandlung und Herstellung,
- bis hin zur Endverpackung in unseren Räumlichkeiten.
Biowest analysiert, klassifiziert und testet seine Produkte vor dem Versand an Kunden weltweit.
Unser Qualitätssystem kann die Rohstoffe bis zu den ursprünglichen Lieferanten und Schlachthöfen zurückverfolgen, wo sie gesammelt wurden.
Das System der vertikalen Integration von Biowest ermöglicht die Zertifizierung der Herkunft und die vollständige Rückverfolgbarkeit der Seren.

FBS-Ursprünge weltweit
Biowest bietet eine breite Palette von Seren an, die sowohl aus Südamerika als auch aus der Europäischen Union (EU) und aus vom US-Landwirtschaftsministerium (USDA) zugelassenen Quellen stammen.
Die Wahl der FBS-Herkunft richtet sich nach den Bedürfnissen der Kunden, den Importanforderungen und dem weltweiten Angebot.
Experten finden in Biowest den idealen Partner für die Erfüllung ihrer Anforderungen, z. B. für die Wahl der Herkunft des Serums, das optimale Leistungen und Ergebnisse liefert.
FBS (Foetal Bovine Serum) gilt als tierisches Nebenprodukt, das nicht für den menschlichen Verzehr bestimmt ist.
Filtration und Verpackung
Rohes gepooltes fötales Rinderserum wird durch drei Serien von 0,1-Mikron-Sterilisationsfiltern gefiltert.
Das steril gefilterte Serum ist gepoolt, um Homogenität zu gewährleisten.
Biowest-Produkte werden in einem aseptischen Abfüllverfahren verpackt.
Wir stellen sicher, dass die industriellen Sterilitätsstandards auf einem Niveau von 10-4 bei jedem Schritt der Herstellung eingehalten werden.
Unsere Produkte weisen eine bakterielle und pilzliche Kontamination von weniger als 1 von 10.000 Einheiten während der gesamten Herstellung auf.
Die höchste Stufe der Sterilitätssicherheit (≥10-6) kann ohne Endsterilisation nicht erreicht werden.
Die Filtration und die Dosierung erfolgen unter Überdruck in HEPA-gefilterten, umweltkontrollierten Räumen.
Jede Charge wird mit einem Analysezertifikat geliefert.
Biowest-Qualitätszertifizierung
Das Sterilitätsprüfverfahren basiert entweder auf der Europäischen oder der US-Pharmacopoeia, je nachdem, wo die Endfiltration stattfindet.
Um die höchste Sterilitätssicherungsstufe zu erreichen, wird eine repräsentative Anzahl von Proben aus jeder Produktionscharge für die Sterilitätsprüfung vor dem Vertrieb ausgewählt.
Alle Biowest-Seren werden auf die Abwesenheit von aeroben und anaeroben Bakterien, Pilzen und Hefen getestet.
Jede Serencharge des Endprodukts wird auf Mykoplasmen getestet.
Die Seren werden mit einem Zellkulturtest in Axcell Biotechnologies-Medien nach der Kulturmethode auf die Abwesenheit von Mycoplasma getestet. Unser Test ist innerhalb der Grenzen der verwendeten Nachweismethode genau.
Je nach Art des Serums wird jede Serumcharge mit Hilfe von Zellkulturtechniken auf kontaminierende Viren getestet.
Die Seren werden durch Inokulation mit GBK-Zellen auf die Abwesenheit der angegebenen Viren getestet. Der Nachweis von Viren erfolgt durch indirekte Immunfluoreszenz. Antikörpertest: Das Vorhandensein spezifischer Antikörper wird mit Hilfe eines ELISA-Tests nachgewiesen. So wird beispielsweise das Serum von Equiden auf das Vorhandensein von Antikörpern gegen die Equine Infektiöse Anämie getestet.
Alle Biowest-pH-Meter werden täglich mit Standardlösungen kalibriert.
Die Osmolalität wird durch eine abgesenkte Gefriertemperatur bestimmt, in Anlehnung an die Europäische Pharmakopöe EU Ph. 2.2.35.
Das Osmometer wird mit rückführbaren Standards kalibriert.
Alle Biowest-Seren werden zur Bestimmung und Quantifizierung des Endotoxingehalts mit einem chromokinetischen – quantitativen Test – Methode D des Europäischen Arzneibuchs EU Ph. 2.6.14 getestet.
Die Resthämoglobinkonzentration in jeder Charge wird durch einen quantitativen und kolorimetrischen Test bestimmt, um zu überprüfen, ob die korrekten Entnahme- und Verarbeitungsverfahren eingehalten wurden.
Proteindetektion | Methodik |
Protein | Biuret Colorimetry |
Albumin | Immunoturbidimetry |
Globulin | Immunoturbidimetry |
Test | Methodik |
ALAT (SGPT) | UV Kinetic at 37°C |
Alkaline Phosphatase | Colorimetric Kinetic at 37°C |
ASAT (SGOT) | UV Kinetic at 37°C |
Bilirubin | DPD / Cafeine Colorimetry |
Calcium | Arsénazo Colorimetry |
Gamma GT | Colorimetric Kinetic at 37°C |
Cholesterol | Cholesterase Trinder Colorimetry |
Creatinine | Colorimetric Kinetic (Jaffé) |
Chloride | Indirect Potentiometry |
Glucose | Hexokinase UV |
Iron | TPTZ Colorimetry |
Lactate Dehydrogenase (LDH) | UV Kinetic at 37°C |
Phosphorus | Phosphomolybdate Colorimetry |
Potassium | Indirect Potentiometry |
Sodium | Indirect Potentiometry |
Tryglicerides | Glycerokinase Trinder Colorimetry |
Urea | Urease UV |
Uric Acid | Uricase Trinder Colorimetry |
Jede Serumcharge wird mit einem ELISA-Verfahren auf IgG getestet.
Jede Charge des Serums wird zur optimalen Unterstützung des In-vitro-Wachstums bestimmter Zelllinien hergestellt.
Jede Charge von Seren entspricht nicht nur unseren strengen Qualitätskontrollspezifikationen, sondern erfüllt auch drei wichtige Leistungskriterien:
- Wachstumsförderung
- Ausplattierungs-Effizienz
- Klonierungs-Effizienz
Die biologische Leistung wird unter Verwendung von Zellkulturmedium, das mit einer Endkonzentration von 10 % Serum ergänzt wurde, bewertet. Während des Testzeitraums werden die Kulturen unter dem Mikroskop auf morphologische Anomalien untersucht, die auf toxische Komponenten im Serum hinweisen könnten.
Die folgenden Zelllinien werden zur Messung des Wachstumspotenzials und der Funktionalität verwendet:
Bovine spongiforme Enzephalopathie (BSE) wird an von Rindern stammendem Material getestet. Gemäß der europäischen Verordnung (EG) Nr. 999/2001 werden die Tiere auf BSE getestet, bevor das entsprechende Blut verarbeitet werden darf. Die EU ist Vorreiter bei den BSE-Tests und der individuellen Kennzeichnung von Tieren durch Ohrmarken. Dies gewährleistet die bestmögliche Rückverfolgbarkeit und das geringste BSE-Risiko. Folglich ist der EU-Ursprung die erste Wahl für Forscher in Japan und anderen selektiven Märkten.
Für Japan und andere ausgewählte Märkte sind die Seren aus der EU die erste Wahl.
Test | Methodik |
Prionics | Western Blot |
Bio-Rad | ELISA |
Hinweis:
Obwohl die Welttiergesundheitsorganisation (OIE) bestätigt, dass Blut und Blutprodukte wie FBS kein Risiko für die Übertragung von BSE darstellen, haben einige Länder immer noch BSE-Anforderungen für FBS – siehe OIE Terrestrial Code 11.4 – BSE.
Alle Biowest-Produkte sind mit Etiketten versehen, auf denen geeignete Lagerungsbedingungen, die Chargennummer und das Verfallsdatum angegeben sind.
Biowest garantiert eine optimale Serumleistung, wenn das Produkt richtig gelagert wird:
- Tierische Seren und Plasmen müssen bei -20°C gelagert werden.
- Beachten Sie das Verfallsdatum.
- Die Haltbarkeit von tierischem Serum beträgt 60 Monate, die von tierischem Plasma 48 Monate.
Bestimmungsgemäße Verwendung

Diese Produkte sind nur für Forschungszwecke oder zur Weiterverarbeitung bestimmt.
Es liegt in der Verantwortung des Endverbrauchers, diese Produkte für ihre spezifische Anwendung zu qualifizieren.
Diese Produkte sind weder für therapeutische, human- oder veterinärmedizinische Anwendungen noch als pharmazeutischer Wirkstoff oder für Lebens- oder Futtermittel geeignet.
Ihre Sicherheit und Effizienz wurde nicht für diagnostische oder andere klinische Anwendungen nachgewiesen.
